Lipases
As lipases são enzimas (pertencentes ao grupo hidrolases) que catalisam óleos, gorduras e triacilglicerol (moléculas de lipídios formadas por três moléculas de ácidos graxos e outra de glicerol). Sua principal função no organismo humano é a hidrólise de gorduras durante o processo da digestão, e transformá-los em ácidos graxos. Catalisam a formação das amidas de ésteres não ativados. Também realizam a esterificação, convertendo cadeias longas de glicerol e ácidos graxos em triacilglicerídeos (síntese reversa). Uma característica que a diferencia de outras enzimas é a sua estabilidade no meio aquoso ou não-aquoso, ao contrário das demais enzimas. As lipases são um grupo especial de esterases (enzimas pertencentes ao grupo das hidrolases que clivam e formam ligações éster nos substratos solúveis em água) (FERNANDES, 2002).
Figura 1 - Reação de catalise da lipase.
Esses biocatalizadores são largamente utilizados, por possuírem diversas vantagens além de acelerar o processo da reação, como sua especificidade, reações mais efetivas em determinadas condições, poder de atuação com substratos sintéticos, rigorosidade quanto ao tipo de reação que catalisam, podendo atuar nos dois sentidos da reação em alguns casos.
Suas aplicações na indústria são as mais diversas, desde a indústria alimentícia para melhorar o sabor dos alimentos, fermentação do vinho e salames, na produção de óleos, na indústria têxtil, produção de papel e nos detergentes como agentes de limpeza e removedor de manchas. Outra aplicação que merece destaque é na produção de fármacos enantiômeros, pois as lipases reconhecem as moléculas quirais e atuam em seus isômeros.
CLASSIFICAÇÃO
As lipases são classificadas da seguinte maneira: regiosseletivas (com mais três subdivisões), tipo-seletivas e enantiosseletivas.
As lipases regiosseletivas ou com especificidade posicional são capazes de diferenciar o posicionamento do triacilglicerol na cadeia, distinguindo o triacilglicerol da cadeia principal na posição mais externa (éster primário) do que está na posição mais interna (éster secundário). São classificadas em três grupos, conforme a sua especificidade e atuação. São estes: lípases 1,3 específicas, lípases ácidos graxos específicas e lípases não específicas.
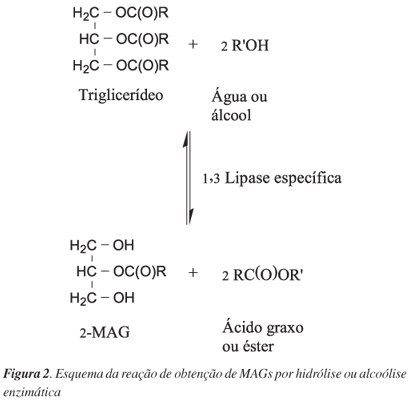
As lipases 1,3 específicas, após sua catalise liberam ácidos graxos presentes nas posições 1-sn e 3-sn dos acilglicerois. A hidrólise total pode resultar em produtos instáveis, que podem ser isomerizados espontaneamente para as posições 1 ou 3 (CARVALHO, P. 2002). As lípases pancreáticas e de alguns vegetais como a mostarda e lupino, são exemplos desta categoria.
Figura 2 – exemplo de lipases 1,3 especificas
As lipases ácidos graxos específicas atuam sobre grupos acilas (radical orgânico R-CO-, a partir da remoção da hidroxila do ácido carboxílico) específicos nas moléculas de triacilgliceróis (TAG), não demonstrando nenhuma especificidade quanto a localização ou estado da acila a ser esterificada. Enquanto as lipases não específicas realizam a hidrolise de TAG de maneira aleatória, sem ter qualquer especificidade quanto à posição do grupo acil ou sua forma, resultando glicerol e ácidos graxos livres. No entanto, há estudos que indicam que a lípase A Candida antarctica realiza a hidrólise na posição 2.
Já as lipases tipo-seletivas, possuem dois parâmetros para desenvolver a catalise: de acordo com o tamanho da cadeia carbônica em questão, ou então a partir da quantidade de insaturações presentes do grupo acila.
As lipases que são enantiosseletivas ou que possuem enantiopreferência atuam em misturas racêmicas (soluções que contém quantidades iguais de dois enantiômeros), convertendo um enantiômero em seu correspondente em éster. Enquanto com o outro, sua reação ocorre tão lentamente ou em alguns casos não chega a ocorrer. Essa variação ocorre de acordo com a maneira que o sítio ativo da enzima está disposto estruturalmente, facilitando o reconhecimento de um dos enantiômeros.
REAÇÕES
As lipases são biocatalizadores responsáveis por catalisar reações de hidrólise de óleos em ácidos graxos livres, monoacilgliceróis (são basicamente monoésteres formados por ácido graxo e glicerol), diacilgliceróis e glicerol. Vários compostos podem ser catalisados por essa enzima, tais como tioésteres, hidroxiácidos, amidas, etc.
Além das reações de hidrólise, as lipases são responsáveis por diversas reações, como por exemplo, a esterificação, transesterificação, amilose (síntese de amidas) entre outras.
Figura 3 – Reações em que as lipases atuam
Hoje, a explicação mais aceita sobre a versatilidade dessa enzima, principalmente na interface polar/apolar, em ácidos graxos de longas cadeias é de que ela possui parte de sua superfície com equilíbrio termodinâmico quando esta é inserida na superfície polar/apolar do substrato que ajustado dessa maneira aperfeiçoa a ação do sitio ativo (ou sitio catalítico) para a quebra da molécula (PASTORE, 2003). Em seu sitio catalítico, estão presentes 3 resíduos de aminoácidos, que são:
1. Resíduo nucleofilico da serina;
2. Resíduo de sitio ácido (aspartato ou glutamato) e
3. Resíduo de histidina.
Essa ordem é sempre seguida, já que ela determina a maneira como as lipases efetuaram a hidrolise (JAERGER, 1999).
O mecanismo de reação da hidrolise provocada pela lípase, ocorre o rompimento da ligação éster, tendo como produto o glicerol e ácido graxo, sendo descrito a seguir em quatro etapas, segundo Jaerger (1999):
“1º) etapa inicial (1) - ocorre um ataque do par de elétrons do átomo de oxigênio (do grupo hidroxila do resíduo nucleofílico da serina), no carbono da carbonila que forma a ligação éster do substrato. A nucleofilicidade apresentada pelo átomo de oxigênio, do grupo hidroxila da serina é aumentada pela presença do aminoácido histidina, pois o próton do grupo hidroxila da 2 serina é transferido para a histidina, que possui um anel imidazol, que estabiliza a carga formada.
2º) etapa intermediária (2) - ocorre formação de uma estrutura tetraédrica transitória, a qual é caracterizada pela carga negativa do átomo de oxigênio da carbonila, que por sua vez, é estabilizada pela interação de ligações de hidrogênios de dois peptídeos através dos grupos NH.
3º) etapa intermediária (3) - o próton do grupo imidazol da histidina forma ligação com o oxigênio do éster presente no tetraedro intermediário, que por sua vez sofre clivagem, liberando um álcool. A molécula da água presente no meio reacionário é ativada pelo aminoácido histidina que libera o grupo OH, no qual ataca o carbono da carbonila do grupo acil ligado ao aminoácido da serina.
4º) etapa final (4) - A histidina doa um próton do grupo imidazol para o átomo de oxigênio da serina, que libera o grupo acil do ácido carboxílico formado.” (JAERGER, 1999).
Além da reação de esterificação, as lipases efetuam reação de transesterificação, na qual é substituído um grupo éster por outro composto. São subdivididas em ácidolise, que é a troca de grupo entre um éster por um ácido, alcoólise troca do éster por um álcool e entre dois ésteres acontece a interesterificação. E diferente da esterificação que possui como um dos produtoras a água, essas reações tem como produto um ácido, álcool e éster respectivamente.
LIPASE LIPOPROTEICA (LPL)
É a enzima de regulação mais importante para a hidrólise de triglicerídeos das lipoproteínas de baixa densidade (WAJCHENBERG, 2000). Elas atuam da seguinte maneira no organismo humano: quando o colesterol é absorvido pelo organismo humano no intestino delgado, necessita ser transportado para o fígado pelos quilomicrions (uma classe das lipoproteínas), então estes seguem pela circulação linfática. Nos capilares, as lipases lipoproteicas agem sobre os quilomicrons, retirando seus triglicerídeos, hidrolisando-os em unidades menores denominadas quilomicrons remanescentes. Essas unidades são removidas da corrente sanguínea por receptores presentes em células hepáticas, onde são metabolizadas pelo fígado.
A insulina e glicocorticóides são os estimuladores fisiológicos da LPL, sendo associado quanto à distribuição da gordura corporal e a principal responsável pela obesidade abdominal. Já o hormônio catecolamina, responsável pelo crescimento e na produção de testosterona nos homens, indicou uma redução significativa na ação da LPL do tecido adiposo.
Figura 4 - esquema de atuação da lipase lipoproteica



Lamparina Galáctica